事实上,诺华公司在国内已开始针对晚发型SMA患儿开展基因治疗临床试验,发生这样的撤稿事件,SMA患者群体势必将产生一定顾虑。但对于医生来说,更重要的是与患者进行详尽沟通,如实告知。大部分家长还是愿意『搏一下』,因为他们可能更多关注临床试验的数据。」
回到该药物本身,国外已有较多临床数据披露。
据美国临床试验注册库,2014年诺华开始了一项评估静脉注射AVXS-101(商品名:Zolgensma)治疗1型脊髓性肌萎缩症(SMN1)安全性和有效性的试验。
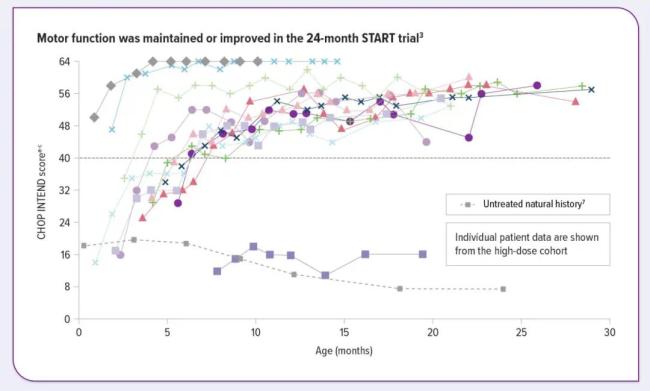
结果显示,为 6 个月之前出现临床症状患儿使用 Zolgensma,输注后 1 月 使用费城儿童医院神经肌肉疾病婴儿测试 CHOP INTEND 评估患儿运动功能,患儿有显著改善。
图片来源:Novartis
JAMA Neurology 2021 年发表了一篇题为 Five-Year Extension Results of the Phase 1 START Trial of Onasemnogene Abeparvovec in Spinal Muscular Atrophy 的文章。在这项研究中,13 名 SMA 1 型患儿接受了单次低剂量或常用剂量的 onasemnogene abeparvovec(商品名:Zolgensma)治疗,观察了给药后 6.2 年。
研究结果指出,对于接受常用剂量治疗的患者,onasemnogeneabeparvovec能够提供持续、持久的疗效,所有患者均存活,并且无需永久通气。8名患者(62%)报告了严重不良事件,但未报告任何特别关注不良事件,暂未发现肝酶升高、血液系统疾病、新发恶性肿瘤或自身免疫性疾病等情况。
而鉴于其急性严重肝损伤、急性肝功能衰竭和转氨酶升高的风险,美国FDA也在其说明书上增添了一处黑框警告。







