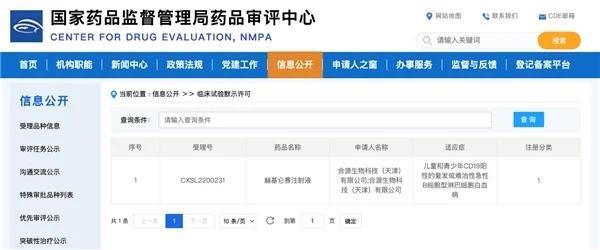
2022年8月19日,国家药品监督管理局药品审评中心(CDE)官网显示,合源生物科技(天津)有限公司(以下简称“合源生物”)赫基仑赛注射液(拟定)(CNCT19细胞注射液,InaticabtageneAutoleucel)用于治疗儿童和青少年复发或难治性急性B细胞型淋巴细胞白血病(r/rB-ALL)的新药临床试验(IND)申请正式获得默示许可。这是赫基仑赛注射液在继获批成人r/rB-ALL的临床试验(受理号:CXSL1800106)和治疗复发或难治性侵袭性B细胞非霍奇金淋巴瘤的临床试验(受理号:CXSL1800107)后的第三项新药临床试验。此次获得新药临床试验许可的是一项多中心、单臂、开放标签的I/II期注册临床试验,将主要评估赫基仑赛注射液用于治疗儿童及青少年(3-18周岁)r/rB-ALL患者的有效性、安全性,及其药代动力学和药效学(PK/PD)特征。
基于早期临床研究中显示的突出的临床价值,赫基仑赛注射液针对r/r B-ALL于2021年获得CDE“突破性治疗药物”认定,并于2022年获得FDA “孤儿药”资格认定。此次新IND获批,标志着赫基仑赛注射液治疗r/r B-ALL从成人拓展到儿童和青少年患者。目前,国内尚未有针对r/r B-ALL的CAR-T细胞治疗药物获批上市。赫基仑赛注射液注册临床研究适应症人群的不断拓展,新药上市进程的快速推进,将极大满足急性淋巴细胞白血病(ALL)患者的临床迫切需求。
白血病是我国儿童最常见的恶性肿瘤,其中72.6%为ALL。尽管目前初诊儿童ALL患者的5年总生存(OS)率达到80%以上,但仍有20%的儿童ALL患者经初始治疗后仍会复发或难治,复发或难治的患儿预后差,临床缺乏有效的治疗手段,再次化疗有效的比例不足20%,且反复化疗对儿童患者的毒性大大增加。尽管部分患者后续可能会接受造血干细胞移植(HSCT),但对于儿童ALL患者,由于移植相关的毒副作用,其长期临床获益仍需进一步确认。CAR-T细胞治疗基于显著的临床疗效和可控的安全性,为儿童r/rB-ALL提供了治愈的希望。